11.10.2016 - 08:41
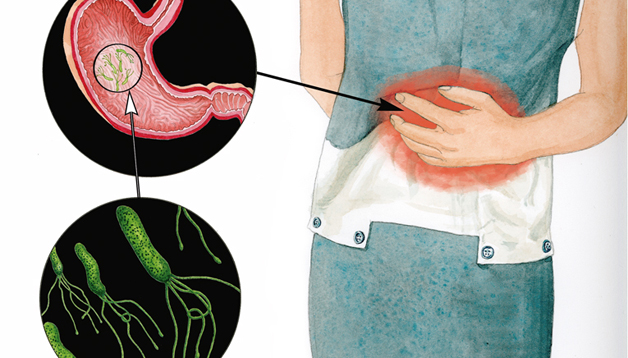
Demostrar que un microorganisme és capaç d’induir o provocar càncer és difícil, ja que un agent infecciós pot desencadenar els primers passos de l’oncogènesi però estar absent en el tumor final. Des que Robert Koch (1843-1910) va establir el 1884 els seus postulats, que serveixen per a poder assegurar que un determinat microorganisme és el responsable d’una determinada malaltia, només en el cas d’Helicobacter pylori s’ha pogut demostrar la relació entre la infecció pel bacteri i l’aparició de gastritis, que pot derivar en càncer d’estómac. Els metges australians Marshall i Warren havien observat freqüentment en teixits ulcerats i malignes uns petits bacteris helicoïdals. Van pensar que el bacteri i no l’estrès era la causa de l’úlcera, com tots els metges creien fins a aquell moment. Per provar aquesta hipòtesi, Marshall va ingerir un cultiu d’H. pylori d’un pacient malalt amb úlcera i va desenvolupar els símptomes típics d’una gastritis, preludi d’una úlcera. Amb tractament amb antibiòtics es va curar. Cent anys després de Koch, i seguint la mateixa base conceptual, es va arribar a la identificació de l’agent etiològic d’una malaltia que podia acabar en un càncer.
Treballs recents han observat la relació que hi pot haver entre el càncer de còlon i la microbiota intestinal. S’ha trobat que la femta de persones amb diversos càncers de còlon tendeix a tenir una composició alterada de bacteris (disbiosi). Si els canvis en la microbiota en pacients amb càncer de còlon són precursors de la malaltia o són una conseqüència del desenvolupament d’un tumor continua sent una incògnita. Què és primer, el canvi en la microbiota o el desenvolupament del càncer? Per investigar aquesta qüestió, s’han fet estudis amb ratolins tractats amb antibiòtics (que alteren la microbiota intestinal) abans de l’administració d’un agent carcinogen i d’un agent inflamatori, i s’han comparat els resultats amb els ratolins que havien rebut només el carcinogen i el tractament inflamatori, sense antibiòtics. Els ratolins tractats amb antibiòtics van tenir significativament menys tumors que els animals amb una microbiota inalterada, cosa que suggereix que els bacteris residents estaven d’alguna manera promovent el càncer. I quan es va transferir microbiota dels ratolins no tractats als tractats amb antibiòtics i a ratolins criats lliures de microbis (es diuen animals gnotobiòtics, és a dir, de “vida coneguda”), els ratolins van desenvolupar més tumors quan s’exposaven als agents carcinògens. Així, els ratolins gnotobiòtics amb transplantament de microbiota de ratolins que tenen tumors també van desenvolupar tumors. No obstant això, s’ha observat que els ratolins gnotobiòtics i tractats amb elevades dosis d’antibiòtics responen pitjor a les teràpies contra el càncer en ratolins.
La relació entre la microbiota humana i el càncer és complexa i encara falta molt per estudiar. Mentre que alguns microbis promouen la proliferació cel·lular, altres semblen protegir-nos contra el creixement cancerós. I en alguns casos les condicions que estimulen un càncer poden tenir l’efecte contrari en uns altres. Necessitem saber què fan els microbis, com interactuen entre ells i amb nosaltres, i com responen als canvis ambientals (per exemple, a la dieta, l’estil de vida, etc.). Aquesta nova informació basada en el coneixement i la modificació terapèutica de la microbiota ofereix possibilitats prometedores en la restauració d’una microbiota saludable i en la modulació de la teràpia del càncer. I, per tant, encara que molt lentament, haurem guanyat una altra batalla contra la mort.
Llegiu l’article sencer a la web de Mètode.
Ricard Guerrero. Membre de l’Institut d’Estudis Catalans i director acadèmic de la Barcelona Knowledge Hub de l’Acadèmia Europaea.
Mercè Berlanga. Professora agregada interina del departament de Microbiologia i Parasitologia de la Universitat de Barcelona.
Carles Puche. Il·lustrador, Barcelona.